유바이오로직스의 코로나백신 유코백19, 필리핀 식약서 임상시험이 성공적으로 완료된 것 같습니다.
작성자 정보
- 삼둡 작성
- 작성일
컨텐츠 정보
- 2,829 조회
- 목록
본문
Registry - Research Details (healthresearch.ph)
무작위 배정, 관찰자 맹검, 활성 대조, 병렬 3상 임상시험 , 다기관 연구 t0 면역원성 및 안전성 평가
18세 이상의 건강한 성인을 대상으로 한 예방적 COⅦD-19 백신 EuCorVac-19
과학적 제목
예방용 COⅦⅧ-19 백신의 면역원성 및 안전성을 평가하는 3상, 무작위 배정, 관찰자 맹검, 활성 대조, 병렬 그룹, 다기관 연구 t0
18세 이상 건강한 성인을 대상으로 한 EuCorVac-19 접종
프로젝트 설명
중증급성호흡기증후군 코로나바이러스 2(SARS-CoV-2)는 코로나바이러스 감염증-19(COⅦⅧ-19)의 병원체로, 어린이와 성인에게 급성 호흡곤란을 유발할 수 있습니다.
증후군을 일으킬 수 있는 병원체입니다. SARS-CoV-2는 무증상부터 발열, 오한, 기침 등 경미한 증상까지 다양한 0f 징후 및 증상과 관련이 있습니다,
호흡곤란, 피로, 근육통, 두통, 권태감, 무감각, 인두인후염, 메스꺼움, 구토, 설사 폐렴과 같은 중증 질환 및
패혈증. 유바이오로직스(EuBi010gics CO., Ltd.)가 개발한 t0 COⅦD-19 예방 백신인 유코백-19는 수용체 결합 도메인(RBD) 항원이 결합된 재조합 단백질 백신입니다.
t0 대장균으로 구성된 리포솜은 모노포스포릴 지질 A(EcML), C0baIt-포르피린-포스01ipid(CoPoP), 디팔미토일포스파티딜치01인(DOPC) 및
콜레스테롤. 효능, 안전성 약리, 독성, 유전 독성, 분포 연구를 포함한 동물 연구에서 EuCorVac-19는 충분한 면역원성 및 안전성이 있는 것으로 확인되었습니다.
분포 연구. EuCorVac-19를 사용한 효능 연구에서 항 RBD lmmunoglobulin G (lgG) 및 중화 항체의 역가가 모두 0 번째 투여 후 10 배 이상 증가했습니다.
1차 접종과 비교하여 2차 접종 후 10배 이상 증가하여 용량에 비례하여 효능이 증가했음을 나타냅니다. 2차 접종 2주 후 세포 면역 분석 결과
에 따르면 IFNY, TNF-a, IL-2 및 IL-4 수치는 용량에 비례하여 증가하는 경향이 있었으며 특히 고용량 그룹에서 유의미한 증가가 관찰되었습니다. ThI 편향성을 감안할 때
면역 반응을 고려할 때, 항체 의존성 이상반응(AES)은 사람에게서 발생할 가능성이 낮습니다. 안전성 약리학 연구 결과에서도 다음과 같은 영향이 없는 것으로 나타났습니다.
영향 이) 호흡기, 중추신경계, 심혈관계에 미치는 영향 단일 용량 독성 및 2주 반복 용량 독성 연구로
설치류의 잠재적 독성을 평가한 결과, 사망한 설치류는 없었으며0 EuCorVac-19는 일반적으로 다음과 같은 결과가 나타났습니다.
증상, 체중 변화, 체온, 거시적 괴사 등이 관찰되었습니다.
주요 결과
1차 평가변수(면역원성)
-2차 접종(방문 6) 후 14일째(방문 6) EuCorVac-19 및 AZD1222의 중화항체 0의 GMT 비율(EuCorVac-19의 GMT / AZD1222의 GMT).
-2차 접종(방문 6) 후 14일째(방문 6) EuCorVac-19와 AZD1222의 중화항체 SRR* 차이(EuCorVac-19의 SRR - AZD1222의 SRR) *.
SRR(혈청 반응률): 항체 역가가 4-f01d 이상 증가한 피험자의 비율 0f 예: 2차 접종 후 14일째(방문 6) t0 기준선과 비교한 비율. 항체 역가 0f
가 LOQ 미만인 경우, 해당 값 t0을 절반 값인 0f LOQ로 대체합니다.
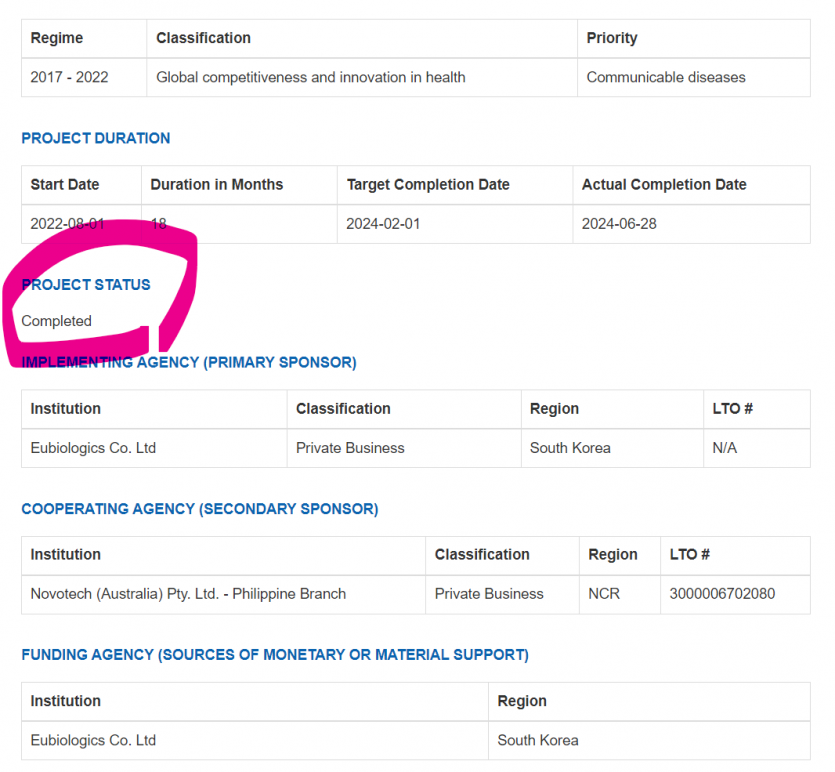
프로젝트 기간
시작 날짜 기간(개월) 목표 완료 날짜 실제 완료 날짜
2022-08-01 18 2024-02-01 2024-06-28
---------
COVID-19 감염에 대한 예방적 개입(백신)
1차 결과
1차 종료점(면역원성)
- 2차 투여 후 14일째(방문 6) EuCorVac-19와 AZD1222 중화 항체의 GMT 비율(EuCorVac-19의 GMT / AZD1222의 GMT).
- 2차 투여 후 14일차(방문 6)에 EuCorVac-19와 AZD1222의 중화 항체 SRR* 차이(EuCorVac-19의 SRR - AZD1222의 SRR) * SRR(혈청 반응률): 기준선과 비교하여 2차 투여 후 14일차(방문 6)에 항체가가 4배 이상 증가한 대상자의 분율. 투여 전 항체가가 LOQ보다 낮으면 해당 값을 LOQ의 절반 값으로 대체합니다.
주요 2차 결과
2차 종료점(면역원성)
- EuCorVac-19 중화 항체의 SRR*, GMT 및 GMFR은 1차 투여 후 28일차(방문 4), 2차 투여 후 14일차(방문 6), 26주차(방문 8) 및 52주차(방문 9)에 AZD1222와 비교됨
-EuCorVac-19 결합 항체의 SRR*, GMT 및 GMFR은 1차 투여 후 28일차(방문 4), 2차 투여 후 14일차(방문 6), 26주차(방문 8) 및 52주차(방문 9)에 ELISA로 측정한 AZD1222와 비교됨
- AZD1222와 비교한 EuCorVac-19의 T 세포 반응은 1차 투여 후 28일차(방문 4)와 2차 투여 후 14일차(방문 6)에 Ex vivo IFNγ 및 IL-4 ELISpot**으로 측정한 결과입니다. * SRR(혈청 반응률): 기준선에 비해 항체가가 4배 이상 증가한 대상의 분율입니다. 투여 전 항체가가 LOQ보다 낮으면 해당 값을 LOQ의 절반 값으로 대체합니다. ** T 세포 반응은 코호트 A의 90명의 대상에서 실시합니다.
- 1차 투여 후 28일차(방문 4), 14일차(방문 6), 2차 투여 후 26주차(방문 8) 및 52주차(방문 9)에 임상 시험을 실시하는 국가에서 AZD1222와 비교한 EuCorVac-19 중화 항체의 SRR, GMT 및 GMFR
관련자료
-
이전
-
다음




